Пропанол-1
Шаблон:Карточка{{#invoke:check for unknown parameters|check |unknown= |ignoreblank= |preview=Неизвестный параметр «_VALUE_» шаблона Вещество |showblankpositional= |CAS|ChEBI|ChemSpiderID|ECB|EINECS|H-фразы|InChI|InChIKey|NFPA 704|P-фразы|PubChem|R-фразы|RTECS|S-фразы|SMILES|nocat|Кодекс Алиментариус|ЛД50|ООН|ПДК|СГС|большие схемы|вещество1|вещество2|вещество3|вещество4|внешний вид|вращение|гибридизация|давление пара|диапазон прозрачности|динамическая вязкость|дипольный момент|заголовок|изображение|изображение слева|изображение справа|изображение2|изоэлектрическая точка|интервал трансформации|картинка|картинка малая|картинка2|картинка3D|картинка 3D|картинка3D2|кинематическая вязкость|конст. диссоц. кислоты|константа В. дер В.|координационная геометрия|коэфф. электр. сопротив.|кристаллическая структура|критическая плотность|критическая темп.|критическая точка|критическое давление|молярная концентрация|молярная масса|наименование|описание изображений слева и справа|описание изображения|описание изображения слева|описание изображения справа|описание изображения2|описание картинки|описание картинки2|описание картинки3D|описание картинки3D2|описание малой картинки|от. диэлектр. прониц.|плотность|поверхностное натяжение|показатель преломления|предел прочности|пределы взрываемости|примеси|проводимость|растворимость|растворимость1|растворимость2|растворимость3|растворимость4|рац. формула|сигнальное слово|скорость звука|сокращения|состояние|твёрдость|темп. воспламенения|темп. вспышки|темп. кипения|темп. кипения пр.|темп. плавления|темп. разложения|темп. самовоспламенения|темп. стеклования|темп. сублимации|температура размягчения|тепловое расширение|теплопроводность|теплоёмкость|теплоёмкость2|токсичность|традиционные названия|тройная точка|угол Брюстера|уд. электр. сопротивление|удельная теплота парообразования|удельная теплота плавления|фазовые переходы|хим. имя|хим. формула|ширина изображения|ширина изображения2|энергия ионизации|энтальпия кипения|энтальпия образования|энтальпия плавления|энтальпия растворения|энтальпия сгорания|энтальпия сублимации|ЕС|удельная теплота парообразования2|удельная теплота плавления2|Номер UN|эмпирическая формула|теплота парообразования|энтальпия раствородия|тепловое расширодие}}
Пропи́ловый спирт (пропан-1-ол, 1-пропано́л, химическая формула — C3H7OH) — органический одноатомный спирт. Встречается в природе в небольших количествах как продукт ферментации, а также, является компонентом сивушного масла. Существует изомер 1-пропанола — изопропиловый спирт (пропан-2-ол, 2-пропанол).
Физические свойства
Бесцветная жидкость со спиртовым запахом, смешивается с водой и образует с ней азеотропную смесь (т. кип. 87,5—88,0°С, 71,8 % по массе 1-пропанола). Растворим в этаноле, диэтиловом эфире, ацетоне, бензоле и других органических растворителях.
Химические свойства
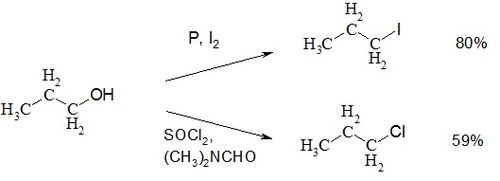
Пропиловый спирт обладает всеми химическими свойствами первичных одноатомных спиртов. Так он может быть превращён в галогеналканы: взаимодействие с йодом и красным фосфором даёт 1-йодпропан с 80 % выходом[1], тогда как взаимодействие хлорида фосфора (III) при катализе хлоридом цинка либо хлористого тионила при катализе ДМФА даёт 1-хлорпропан[2].
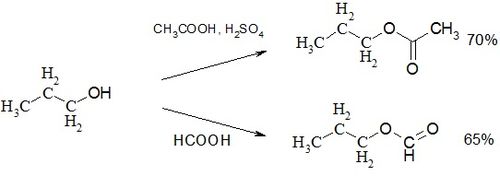
Взаимодействие 1-пропанола с уксусной кислотой в присутствии серной кислоты приводит к образованию пропилацетата[3]. Кипячение только с муравьиной кислотой в течение суток даёт пропилформиат с выходом 65 %.
.
Окисление бихроматом калия серной кислотой в условиях отгонки образующего пропаналя позволяет получать его с 50 % выходом[4]. Более глубокое окисление хромовым ангидридом даёт пропионовую кислоту.

Взаимодействие с щелочными металлами даёт соответствующие пропиолаты металлов. Причём реакция протекает менее интенсивно чем с этиловым спиртом и намного менее интенсивно, чем с водой.
Получение
Метод получения в промышленности — гидроформилирование этилена с последующим гидрированием образовавшегося пропаналя:
1-Пропанол получается в качестве побочного продукта при сбраживании зерна на этанол, однако данный способ получения не имеет особого промышленного значения.
Применение
1-Пропанол применяют в качестве растворителя для восков, полиамидных чернил, природных и синтетических смол, полиакрилонитрила; в производстве полиэтилена низкого давления; для получения карбометоксицеллюлозы; как обезжириватель металлов; сорастворитель поливинилхлоридных адгезивов; желатинирующий и пластифицирующий агент целлюлозноацетатных плёнок; алкилирующий агент. Его используют также для синтеза пропионовой кислоты, пропионового альдегида, пропилацетата, пропиламина, ПАВ, пестицидов, некоторых фармацевтических препаратов.
Топливо
1-Пропанол имеет высокое октановое число (118)[5]. Однако производство его слишком дорого для того, чтобы он стал широко применяемым топливом.
Токсикология
Употребление пропилового спирта, также как и этилового спирта, вызывает алкогольное опьянение. В организме человека пропиловый спирт окисляется до пропионовой кислоты, более едкой, чем уксусная кислота, в связи с чем токсичность пропилового спирта значительно выше, чем у этилового (ЛД50 для пропилового спирта 1870 мг/кг, для этилового спирта 7060 мг/кг). У метилового спирта, ЛД50 составляет 1500 мг/кг.
ПДК пропилового спирта в воздухе рабочей зоны 10 мг/м3 (среднесменная за 8 часов) и 30 мг/м3 (максимально разовая)[6], в атмосферном воздухе населенных пунктов — не более 0,3 мг/м3.
По данным[7] порог восприятия запаха мог достигать (среднее значение в группе) 540[8] и даже 25000 мг/м3; в работе[9] — 660 мг/м3 (то есть в 66 (22) раза выше ПДКрз).
На 2011 год был зафиксирован один смертельный случай отравления пропиловым спиртом[10].
Литература
Примечания
- ↑ Органикум. Том 1. Москва, Мир, 1992, стр. 274
- ↑ Методы получения химических реактивов и препаратов. Москва, ИРЕА, Выпуск 2, 1961, стр. 45 (см. стр. 46)
- ↑ Органикум. Том 2. Москва, Мир, 1992, стр. 84 (см. табл. на стр. 85)
- ↑ Синтезы органических препаратов. Сборник 2.Москва, Иностранная Литература, 1949, стр. 424
- ↑ Шаблон:Cite web
- ↑ Шаблон:Книга
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья
- ↑ Шаблон:Cite web