Реакция Манниха
Реакция Манниха — метод аминометилирования енолизующихся карбонильных соединений с образованием β-аминокарбонильных соединений — оснований Манниха.
Реакция открыта в 1912 году Карлом Маннихом при действии формальдегида и вторичных аминов на кетоны (первоначально — антипирин)[1]:
В настоящее время реакция Манниха используется для аминометилирования не только карбонильных соединений, но и различных C-нуклеофилов — алифатических нитросоединений, ацетиленов, α-алкилпиридинов, фенолов, электронизбыточных гетероциклических соединений, при этом аминоалкилирование может происходить как действием смеси неенолизирующегося альдегида и вторичного амина, так и действием иминиевых солей.
Механизм
В классическом варианте реакция Манниха - это трёхкомпонентная конденсация, в которой участвуют кетон, формальдегид и вторичный амин, либо в условиях кислотного катализа.
Взаимодействие формальдегида и амина ведёт к образованию соли α-метилоламина, которая отщепляет воду, образуя диалкилметилениминиевую соль, являющуюся сильным электрофилом:
В свою очередь, в условиях кислой среды происходит енолизация кетона с образованием нуклеофильного енола:
после чего иминиевый ион атакует C-нуклеофильный центр енола с образованием основания Манниха:
Модификации
Кроме смеси формальдегида и вторичного амина, образующих иминиевую соль, для проведения реакции Манниха используются и их синтетические эквиваленты, например, бис(диметиламино)метан, который при обработке трифторуксусной кислотой образует трифторацетат диметилметилидениминиевой соли, являющийся активным электрофилом:
- ,
аналогичным образом бис(диметиламино)метан применяется в комбинации и с другими кислотами (в частности, фосфорной при диаминометилировании ферроцена[2]).
Поскольку в классическом варианте реакция Манниха происходит с выделением воды и, как правило, в кислотных условиях, то в некоторых случаях в реакции в качестве электрофильного агента используются заранее синтезированные иминиевые соли, например, коммерчески доступную соль Эшенмозера (йодид диметилметилиденаммония H2C=N+(CH3)2 I-). Использование таких солей снимает ограничения классического варианта реакции Манниха и позволяет проведение диаминометилирования в некислотных и безводных условиях, например, в случае образуемых in situ силилированных эфиров енолов либо при взаимодействии с литийорганическими соединениями:
В качестве CH-кислотных компонент в реакции Манниха кроме карбонильных соединений могут быть использованы алифатические нитросоединения:
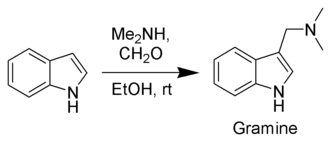
и электронизбыточные ароматические (например, фенолы, ферроцены) и гетероциклические соединения; так, например, диаминометилирование индола по Манниху ведёт к образованию алкалоида грамина:
Ещё одним вариантом реакции Манниха, в которой вместо комбинации формальдегида с первичными алифатическими аминами используется комбинация ароматических альдегидов и аминов является аминобензилирование фенолов по Бетти[3]:
При замене вторичных аминов на тиолы протекает реакция, аналогичная в реакции Манниха, ведущая к образованию замещенных сульфидов, в роли CH-компонент в этой модификации выступают электронобогащенные ароматические и гетероциклические соединения (β-нафтол, индол)[4]:
Синтетическое применение
Продукты реакции — основания Манниха — нашли широкое применение в органическом синтезе.
Так, метилированием оснований Манниха с дальнейшим расщеплением по Гофману образовавшихся четвертичных аммониевых солей является методом синтеза енонов (α-метиленкарбонильных соединений):
Такой подход использовался, в частности, для введения в метиленового фрагмента в α-положение по отношению к альдегидной группе при синтезе бреветоксинов A[5] и B[6].
Реакция Манниха широко применяется в синтезе гетероциклических соединений — в том числе и при биомиметическом синтезе природных соединений как метод построения углеродного или гетероциклического скелета. Так, синтез тропинона по Робинсону из янтарного диальдегида, ацетондикарбоновой кислоты и метиламина представляет собой модифицированный вариант реакции Манниха, в которой циклическая иминиевая соль, образующаяся из янтарного диальдегида, алкилирует енольную форму ацетондикарбоновой кислоты[7]:
Другим примером являются различные методы аннелирования с использованием внутримолекулярной реакции Манниха, например, синтез пирролизидинового ядра[8]:
или синтез 1,2,3,4-тетрагидроизохинолинов по Пикте-Шпенглеру[9]:
Примечания
- ↑ Шаблон:Статья
- ↑ Daniel Lednicer and Charles R. Hauser. N,N-Dimethylaminomethylferrocene methiodide. Organic Syntheses, Coll. Vol. 5, p.434 (1973); Vol. 40, p.31 (1960). Шаблон:Wayback
- ↑ M. Betti. β-Naphthol phenylaminomethane. Organic Syntheses, Coll. Vol. 1, p.381 (1941); Vol. 9, p.60 (1929). Шаблон:Wayback
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 305.
- ↑ Шаблон:Статья