Феррат бария
Шаблон:Карточка{{#invoke:check for unknown parameters|check |unknown= |ignoreblank= |preview=Неизвестный параметр «_VALUE_» шаблона Вещество |showblankpositional= |CAS|ChEBI|ChemSpiderID|ECB|EINECS|H-фразы|InChI|InChIKey|NFPA 704|P-фразы|PubChem|R-фразы|RTECS|S-фразы|SMILES|nocat|Кодекс Алиментариус|ЛД50|ООН|ПДК|СГС|большие схемы|вещество1|вещество2|вещество3|вещество4|внешний вид|вращение|гибридизация|давление пара|диапазон прозрачности|динамическая вязкость|дипольный момент|заголовок|изображение|изображение слева|изображение справа|изображение2|изоэлектрическая точка|интервал трансформации|картинка|картинка малая|картинка2|картинка3D|картинка 3D|картинка3D2|кинематическая вязкость|конст. диссоц. кислоты|константа В. дер В.|координационная геометрия|коэфф. электр. сопротив.|кристаллическая структура|критическая плотность|критическая темп.|критическая точка|критическое давление|молярная концентрация|молярная масса|наименование|описание изображений слева и справа|описание изображения|описание изображения слева|описание изображения справа|описание изображения2|описание картинки|описание картинки2|описание картинки3D|описание картинки3D2|описание малой картинки|от. диэлектр. прониц.|плотность|поверхностное натяжение|показатель преломления|предел прочности|пределы взрываемости|примеси|проводимость|растворимость|растворимость1|растворимость2|растворимость3|растворимость4|рац. формула|сигнальное слово|скорость звука|сокращения|состояние|твёрдость|темп. воспламенения|темп. вспышки|темп. кипения|темп. кипения пр.|темп. плавления|темп. разложения|темп. самовоспламенения|темп. стеклования|темп. сублимации|температура размягчения|тепловое расширение|теплопроводность|теплоёмкость|теплоёмкость2|токсичность|традиционные названия|тройная точка|угол Брюстера|уд. электр. сопротивление|удельная теплота парообразования|удельная теплота плавления|фазовые переходы|хим. имя|хим. формула|ширина изображения|ширина изображения2|энергия ионизации|энтальпия кипения|энтальпия образования|энтальпия плавления|энтальпия растворения|энтальпия сгорания|энтальпия сублимации|ЕС|удельная теплота парообразования2|удельная теплота плавления2|Номер UN|эмпирическая формула|теплота парообразования|энтальпия раствородия|тепловое расширодие}}
Феррат бария — это неорганическое химическое соединение. Является бариевой солью железной кислоты.
Физические свойства
Соль представляет собой нерасстворимый порошок бордового цвета.
Феррат бария обладает парамагнитными свойствами из-за двух неспаренных электронов и имеет тетраэдрическую молекулярную геометрию[1].
Структура и физические характеристики
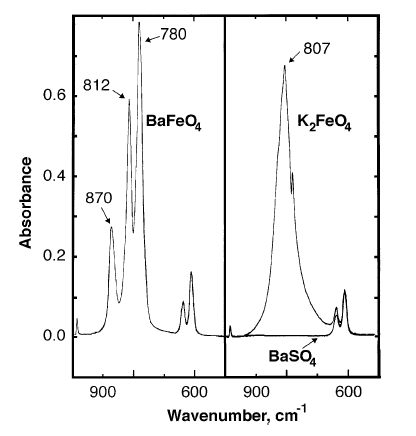
Пики поглащаемости инфракрасного спектра: 870, 812, 780 см-1.
BaFeO4 подчиняется закону Кюри-Вейсса и имеет магнитный момент (2,92 ± 0,03) * 10-23 А*м2 (3,45 ± 0,1 БМ) с константой Вейсса −89 К[2].
Его пространственная группа — Pnma, а параметры решетки составляют a = 0,8880 нм, b = 0,5512 нм и c = 0,7214 нм[3].
Химические свойства
Феррат бария является наиболее стабильным из соединений феррата(VI).
Разлагается при температуре ≈ 120 °C на оксид бария, оксид железа(ll) и кислород.
На практике образуется смесь оксидов железа(ll-lll).
Феррат бария может быть легко разложен всеми растворимыми кислотами, включая угольную кислоту.
Если диоксид углерода пропустить через воду, в которой суспендирован феррат бария, он полностью разложится с образованием карбоната бария, гидроксида железа(lll) и кислорода. Щелочные сульфаты разлагают феррат бария, который не был высушен, образуя сульфат бария, гидроксид железа(lll) и кислород[4][5].
Производство
Феррат бария в основном получают двумя способами. Сухой синтез обычно выполняется с использованием высоких температур, например, путем сплавления гидроксида бария и гидроксида железа(II) в присутствии кислорода до температуры около 800-900 °C[6].
Добавление растворимой соли бария к раствору феррата щелочного металла приводит к образованию темно-бордового осадка феррата бария. Это также качественная реакция на ферраты[7].
Феррат бария можно получить добавлением оксида бария к смеси гипохлорита натрия и нитрата железа при комнатной температуре. Чистоту продукта можно повысить, проводя реакцию при низкой температуре в отсутствие атмосферного диоксида углерода и быстро фильтруя и высушивая осадок, что снижает соосаждение гидроксида бария и карбоната бария в качестве примесей[8].
Применение
Все ферраты — очень сильные окислители (более сильные, чем перманганаты). Эти свойства применяются для органического синтеза[5].
Другие его применения включают удаление цвета, удаление роданинов и цианидов (реагирует с ними до безопасных комплексов, в частности гексацианоферрата бария), уничтожение бактерий и очистку загрязненных и сточных вод.
Соли феррата(VI) являются энергетическими катодными материалами в батареях «супер-железо». Катоды, содержащие соединения феррата(VI), называются катодами «супер-железо» из-за их высокоокисленной железной основы, множественного переноса электронов и высокой внутренней энергии. Среди всех солей феррата(VI), феррат бария поддерживает необычайно легкую передачу заряда, что важно в области высокой мощности щелочных батарей[9].