Галогенирование

|
Фтор |
|---|---|

|
Хлор |

|
Бром |

|
Иод |
Галогенирование (галоидирование) — процесс введения галогена в молекулу органического вещества, осуществляемый за счёт реакции замещения или присоединения.
Заместительное галогенирование
Инициация заместительного галогенирования при работе с непредельными углеводородами, как правило, происходит под действием облучения по свободнорадикальному цепному механизму[1]:
Данная схема реакции применима также и к жирноароматическим соединениям, однако в присутствии кислот Льюиса галогенирование их углеводородных цепей протекает по электрофильному механизму[1]:
По механизму электрофильного замещения также протекает реакция галогенирования в ядра ароматических и гетероароматических соединений в присутствии апротонных или протонных кислот, а в случае, если в ядрах присутствуют пассивирующие заместители реакция может идти под действием катиона галогена, который образуется из молекулярного галогена и соли Ag в среде сильной протонной кислоты — реакция Биркенбаха-Губо-Уотерса[1].
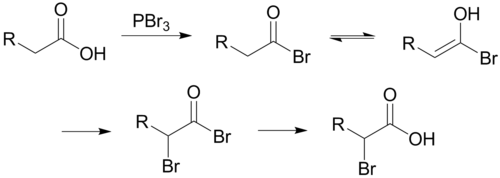
Галоидирование алифатических карбоновых кислот в α-положение проводится хлором или бромом в присутствии красного фосфора Шаблон:Нет АИ или соответствующих хлорида или бромида фосфора(III) — Шаблон:Не переведено 4 — замещение идет через присоединение галогена к енольной форме[1][2]:
Галогенирование алкенов, жирноароматических и гетероароматических соединений осуществляется их взаимодействием с N-бромамидами или N-бромимидами (обычно N-бромсукцинимидом) в присутствии пероксидов в аллильное или бензильное положение — реакция Воля-Циглера[1][3].
Присоединительное галогенирование
К аренам галогены присоединяются, как правило, по радикальному механизму под действием света или температуры[1]:
По кратной связи галогены присоединяются и по электрофильному, и по радикальному механизму, однако в случае электрофильного присоединения может наблюдаться несоблюдение правила Марковникова, так как образуется промежуточный мостиковый катион. Способность образовывать такие катионы возрастает в ряду F → Cl → Br → I[1].