Циангидрины

Циангидри́ны (α-гидроксинитрилы, нитрилы α-оксикислот) — соединения, содержащие нитрильную и гидроксильную группы при одном углеродном атоме, формально могут считаться продуктами присоединения синильной кислоты к альдегидам и кетонам[1].
По номенклатуре ИЮПАК циангидрины именуются как гидроксинитрилы, однако используются и тривиальные названия, образованные добавлением суффикса -циангидрин к названию карбонильного соединения-предшественника, например, — ацетонциангидрин (2-гидрокси-2-метилпропаннитрил).
Свойства и реакционная способность
Реакционная способность циангидринов обусловлена наличием спиртовой и нитрильной групп с некоторыми особенносями реакционной способности гидроксила, обусловленной электронакцепторным влиянием нитрильной группы.
Так, циангидрины, как и спирты, ацилируются хлорангидридами карбоновых кислот, этерифицируются азотной кислотой с образованием нитроэфиров[2], присоединяются к виниловым эфирам с образованием ацеталей[3], реагируют с пентахлоридом фосфора с замешением гидроксила на галоген, образуя α-хлорнитрилы.
Однако при взаимодействии с аммиаком и гидразином, в отличие от алифатических спиртов, происходит замещение гидроксила на амино- или гидразиновую группу, при этом образуются α-амино или α-гидразинонитрилы.
Под действием водоотнимающих агентов (пентаоксида фосфора , оксихлорида серы ) или катализаторов при нагревании алифатические циангидрины отщепляют воду, образуя 1,2-ненасыщенные нитрилы, так, из циангидрина ацетальдегида (нитрила молочной кислоты) образуется акрилонитрил:
- .
Как и нитрилы, циангидрины гидролизуются до амидов и далее до α-гидроксикарбоновых кислот, в жестких условиях в случае алифатических циангидринов гидролиз может сопровождаться отщеплением гидроксильной группы, что ведет к образованию 1,2-ненасыщенных амидов или карбоновызх кислот. Так, ацетонциангидрин при нагревании Шаблон:Nobr серной кислоте образует метакриламид[4]:
- .
Синтез
Действие цианидов на карбонильные соединения
Основным методом синтеза как в лабораторной практике, так и в промышленности является присоединение цианистого водорода к карбонильным соединениям:
- .
В эту реакцию вступают алифатические, большинство ароматических и многие гетероциклические альдегиды, алифатические и алициклические кетоны. Ароматические кетоны в реакцию не вступают. Образованию циангидринов препятствуют стерические затруднения, в случае ароматических и гетероциклических альдегидов, в которых ароматический заместитель стабилизирует образование циангидрин-карбаниона; побочным процессом является бензоиновая конденсация карбаниона со второй молекулой альдегида:
Реакция может проводиться в щелочной водной или водно-спиртовой среде с цианидами щелочных металлов в присутствии или при температурах Шаблон:Nobr (модификация Ульте) либо с использованием цианистого водорода в момент выделения при добавлении уксусной кислоты в водный раствор цианида щелочного металла и карбонильного соединения при Шаблон:Nobr (модификация Уреха).
Циангидрины могут быть также получены действием цианидов на бисульфитные производные альдегидов и кетонов:
В качестве «безцианидного» метода синтеза циангидринов альдегидов используется обменная реакция с циангидридами кетонов (обычно с легкодоступным ацетонциангидрином):
- .
Для синтеза циангидринов ароматических кетонов, не образующихся в классических условиях реакции, в качестве синтетического эквивалента цианид-иона или синильной кислоты используется триметилсилилцианид, что позволяет синтезировать циангидрины бензофенонов. Реакция идет через образование триметилсилильных производных циангидринов, которые затем в кислотных условиях гидролизуются до циангидринов[5].
Использование триметилсилилцианида также позволяет синтезировать триметилсилилциангидрин p-бензохинона[6].
Другие методы синтеза
Циангидрины могут быть синтезированы и функционализацией соответствующих α-гидроксисоединений.
Так, оксимы α-гидроксиальдегидов под действием кислотных и ацилирующих агентов (уксусный ангидрид и т. п.) образуют циангидрины:
- .
Применение
Промышленное применение
Ацетонциангидрин является крупнотоннажным продуктом органического синтеза и используется как сырье в производстве производных метакриловой кислоты — метилметакрилата:
- .
и других соединений, применяемых в качестве мономеров для получения полимеров — полиакрилатов.
Использование в органическом синтезе
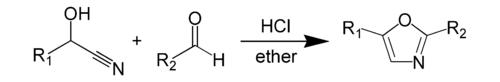
Взаимодействие циангидридов альдегидов с альдегидами в присутствии хлороводорода в безводных условиях приводит к образованию оксазолов, эта реакция идет через присоединение хлороводорода к нитрильной группе циангидрина с образованием имидоилхлорида используется как препаративный метод синтеза (синтез оксазолов по Фишеру)[7]:
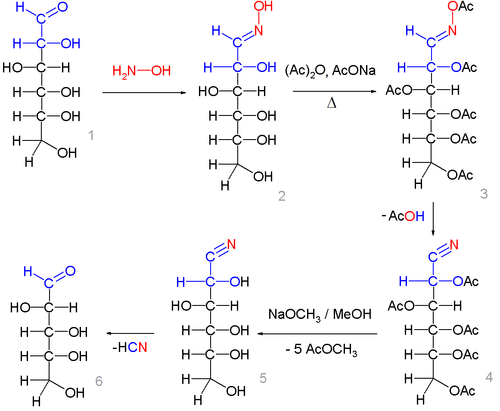
Образование циангидринов из альдоз является первой стадии их гомологизации по Килиани-Фишеру:
Синтез циангидринов — нитрилов альдоновых кислот из оксимов альдоз с дальнейшим отщеплением от них цианистого водорода используется в химии углеводов как метод укорочения углеродной цепи альдоз на одно звено (реакция Воля):
Циангидрины также используются в модифицированном синтезе α-аминокислот по Штреккеру в модификации Тимана. В этом методе циангидрины вводятся в реакцию с аммиаком с образованием α-аминонитрилов, которые далее гидролизуются до α-аминокислот:
Триметилсилилциангидрины, в отличие от циангидринов, могут быть депротонированы действием диизопропиламида лития до соответствующих карбанионов:
которые могут быть введены в реакцию с альдегидами или кетонами, образуя после дальнейшего гидролиза ацилоины:
- .
Триметилсилилоксинитрил-карбанионы также могут быть алкилированы алкилгалогенидами и далее гидролизованы до кетонов заданной структуры:
- .
Нахождение в природе

Циангидрины являются агликонами цианогенных гликозидов, встречающихся во многих видах растений: бензальдегидциангидрин амигдалина растений рода слива Prunus и дуррина сорго, ацетонциангидрин линамарина маниоки и льна, этилметилкетонциангидрин лотаустралина маниоки, клевера ползучего и Lotus australis и др.
Высвобождающиеся при гидролизе цианогенных гликозидов циангидрины в физиологических условиях разлагаются с образованием соответствующего карбонильного соединения и синильной кислоты, что обуславливает токсичность растений, содержащих цианогенные гликозиды.
У двупарноногих многоножек рода Aphelora — A. corrugata и A. trimaculata бензальдегидциангидрин (наряду с бензоилцианидом) синтезируется и накапливается в ядовитых железах и в случае опасности гидролизуется с выделением синильной кислоты[8].
Примечания
Литература
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite journal
- ↑ Шаблон:Cite journal
- ↑ Шаблон:Cite journal
- ↑ Paul G. Gassman and John J. Talley. CONVERSION OF KETONES TO CYANOHYDRINS: BENZOPHENONE CYANOHYDRIN. Org. Synth. 1981, 60, 14 Шаблон:Wayback DOI: 10.15227/orgsyn.060.0014
- ↑ Tom Livinghouse. TRIMETHYLSILYL CYANIDE: CYANOSILATION OF p-BENZOQUINONE. Org. Synth. 1981, 60, 126 Шаблон:Wayback DOI: 10.15227/orgsyn.060.0126
- ↑ Li, J. J. Fischer Oxazole Synthesis. In Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications, 4th ed.; Springer-Verlag Berlin Heidelberg: New York, 2003, 229—230. (Review). ([1] Шаблон:Wayback)
- ↑ Шаблон:Cite web