Медь
Шаблон:Карточка химического элемента Шаблон:Элемент периодической системы Медь (химический символ — Cu, от Шаблон:Lang-la) — химический элемент 11-й группы (по устаревшей классификации — побочной подгруппы первой группы, IB) четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29.
В виде простого вещества медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки).
C давних пор широко используется человеком.
История
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-ГююкШаблон:Sfn. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудийШаблон:Sfn.
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопках. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 см по сторонам и 0,5 мм толщиной. Монета имела хождение по всему западному побережью Южной Америки, в том числе и в государстве Инков[1].
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехникеШаблон:Sfn.
Происхождение названия
Латинское название меди Cuprum (древнелат. Шаблон:Lang-la2) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется Шаблон:Lang-grc2, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Шаблон:Lang-la2 (Шаблон:Lang-sa, Шаблон:Lang-got, Шаблон:Lang-de, Шаблон:Lang-en) означает руда или рудник.
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра[2], и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской[2][3]. С Гумёшевским рудником Полевского, — крупнейшим в XVIII−XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломлённым народным сознанием образом богини Венеры[2].
Русское слово медь (и медный) встречается в древнейших русских литературных памятниках: Шаблон:Lang-cu, «медь» не имеет чёткой этимологии, возможно, исконное слово[4][5]. В. И. Абаев предполагал, что, возможно, слово „Медь“ произошло от названия страны Мидия: *Мѣдь из иранского Мādа — через посредство Шаблон:Lang-el[6]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл»[6].
Нахождение в природе

Среднее содержание меди в земной коре (кларк) — (0,78-1,5)·10−4[7]% (по массе)[8]. В морской и речной воде содержание меди гораздо меньше: 3·10−7 % и 10−7 % (по массе) соответственно[8].
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[9]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[10].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства

Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[11] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5—58 МСм/м[12]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = (атом/м³).
Изотопы меди
Шаблон:Main Природная медь состоит из двух стабильных изотопов — 63Cu (изотопная распространённость 69,1 %) и 65Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа[13].
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
- Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырьё содержит 0,5—2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400 °C :
Затем обожжённый концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает, и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезёма выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической (черновой) меди:
Получаемая металлическая (черновая) медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкислённого раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
- Также чистую медь можно получить и в процессе экзотермической реакции восстановления оксида меди водородом:
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод
Электролиз раствора сульфата меди:
Химические свойства
Возможные степени окисления

В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, Концентрированной селеновой и хлорной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной горячей серной кислотой:
C разбавленной серной кислотой при нагревании в присутствии кислорода в воздухе:
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С «царской водкой»:
С концентрированной горячей соляной кислотой:
C разбавленной соляной кислотой в присутствии кислорода:
C разбавленной соляной кислотой в присутствии перекиси водорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода при температуре 200 °C и до оксида меди(II) при избытке кислорода при температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
С йодом (йодида меди(II) не существует):
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
С концентрированной соляной кислотой и хлоратом калия:
С хлоридом железа(III):
Вытесняет менее активные металлы из их солей:
Соединения меди(I)
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также присутствую не растворимые в воде комплексы(например, дихлорокупрат(I)-ион [CuCl2]− устойчив:
- )
Следует обратить внимание на то, что сульфат меди(I) нестабилен Он мгновенно разлагается и переходит в устойчивый сульфат меди(II).
- Большинство соединений имеют белую окраску либо бесцветны.
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
Примером диспропорционирования может служить реакция оксида меди(I) с разбавленной серной кислотой:
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета, который разлагается при температуре 1800°С:
Можно восстановить до элементарной меди:
Также протекает процесс алюминотермии:
Реагирует с концентрированными растворами щелочей:
С концентрированной соляной кислотой:
С разбавленными галоген кислотами(Hal = Cl, Br, I):
С разбавленной соляной кислотой в присутствии кислорода:
С концентрированной азотной кислотой:
С концентрированной серной кислотой:
С разбавленной серной кислотой:
С гидросульфитом натрия:
С аммиаком:
С раствором аммиака:
С азотистоводородной кислотой в разных условиях при охлаждении:
С серой:
С Сульфидом меди(I):
С кислородом:
С хлором:
С оксидами щелочных металлов(Ме = Li, Na, K, Rb, Cs):
Соответствующий гидроксид CuOH (жёлтого цвета) разлагается при температуре 100°С с образованием оксида меди(I).
Гидроксид CuOH проявляет основные свойства.
Также реагирует с раствором аммиака:
Реагирует с гидроксидом калия:
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует оксид CuO чёрного цвета, который разлагается при температуре 1100 °С:
Реагирует с раствором аммиака с образованием Реактива Швейцера:
Растворяется в концентрированных щелочах с образованием комплексов:
При сплавлении с щелочами образуются купраты металлов:
С азотной кислотой:
Реагирует с йодоводородной кислотой с образованием йодида меди(I), так как йодида меди(II) не существует:
Протекают процессы магниетермии и алюминотермии:
Также можно восстановить до элементарной меди следующими способами:
Оксид меди(II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соответствующий гидроксид Cu(OH)2 (голубого цвета), который при длительном стоянии разлагается, переходя в оксид меди(II) чёрного цвета:
Также в избытке влаги возможно окисление меди, и переход в гидроксид куприла, в котором степень окисления меди +3:
При нагревании до 70 °С разлагается:
Реагирует с растворами концентрированных щелочей с образованием гидроксокомплексов синего цвета (это подтверждает преимущественно основный характер Cu(OH)_2):
С образованием солей меди(II) растворяется во всех кислотах(в том числе кислотах окислителях) кроме йодоводородной:
Реакция с йодоводородной кислотой отличается тем, что образуется йодид меди(I), так как йодида меди(II) не существует:
Реакция с водным раствором аммиака является из важных в химии, так как образуется реактив Швейцера (растворитель целлюлозы):
Также суспензия гидроксида меди реагирует с углекислым газом с образованием дигидроксокарбонатом меди(II):
Большинство солей двухвалентной меди имеют синюю или зелёную окраску. При растворении солей меди(II) в воде образуются голубые аквакомплексы [Cu(HШаблон:SubO)Шаблон:Sub]2+. Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга). Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды

Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Имеются данные о получении сесквиоксида Cu2O3[14], также известны различные купраты(III), как в виде смешанных оксидных систем с другими металлами, например, серебром – Ag2Cu2O4[15], так и координационных соединений; наличие у меди конфигурации d8 в этих соединениях является дискуссионной[16].
Гексафторкупраты(III) и (IV) получают действием фтора на соли меди и щелочных металлов при нагревании под давлением. Они бурно реагируют с водой и являются сильными окислителями.
Комплексы меди(III) с ортопериодатами и теллуратами относительно стабильны и предложены как окислители в аналитической химии. Описано много комплексов меди(III) с аминокислотами и пептидами.
Аналитическая химия меди

Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этом сульфид меди выпадает в далее взвешиваемый осадок.
- В растворах, при отсутствии мешающих ионов, медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724—0,0180 мкОм·м/[12]), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[17].

Теплообмен

Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[18], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Музыкальные инструменты
Из бронзы и латуни изготавливаются музыкальные инструменты:
- Ударные инструменты, металлофоны — колокола и колокольчики, поющие чаши, тарелки, гонги.
- Медные духовые инструменты. Для их изготовления кроме латуни также используется т. н. двойная латунь с повышенным содержанием меди — томпак или полутомпак.
Сплавы
Сплавы на основе меди


В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди.
Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Медь и её сплавы латунь и бронза обладают высокой коррозионной стойкостью, электро- и теплопроводностью, антифрикционными показателями. При этом медь хорошо сваривается и обрабатывается резанием.[19]
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[20].
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 °C , обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Сплавы, в которых медь значима

Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия-бария-меди (купрата) YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за того, что медь является катализатором полимеризации ацетилена (образует соединения меди с ацетиленом), трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[21].
Медь может быть использована для снижения переноса инфекции в лечебных учреждениях через поверхности, к которым прикасается рука человека. Из меди могут быть изготовлены ручки дверей, водозапорной арматуры, перила, поручни кроватей, столешницы[22].
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм[23].
Также медь применяется в пиротехнике для окрашивания пламени в синий цвет[24][25][26].
Производство, добыча и запасы меди
Мировой рынок
Шаблон:Также По объёму мирового производства и потребления металлов медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляли 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы[27], в 2021 году — 880 млн. тонн[28]. На долю России по состоянию на 2021 год приходилось около 2,2 % общих мировых запасов[28].
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т[27][29]. Мировое производство меди в 2007 году составляло[30] 15,4 млн т, а в 2008 году — 15,7 млн т. Добыча меди в 2022 году составила 21,9 млн. тонн, производство рафинированной меди — 24,6 млн. тонн [31]. Потребление меди в 2021 году — 25 млн. тонн[32]. Таким образом, при нынешних темпах потребления текущих запасов меди хватит примерно на 35 лет.
Объём мирового потребления меди в 2023 году, по оценкам компании «Норникель» 2022 года, должен составить 25,4 млн тонн (рост на 2 % по отношению к прошлому году). В то же время «Норникель» прогнозирует объём добычи меди в 2023 году в размере 22,4 млн тонн (рост на 2 % год к 2022 году). Объём дефицита рынка прогнозировался на уровне 160 тыс. тонн.[33]
Лидеры производства (по состоянию на 2022 год, млн. тонн)[34]:
- Шаблон:Флагификация – 5,200,
- Шаблон:Флагификация – 2,200,
- Шаблон:Флагификация – 2,200,
- Шаблон:Флагификация – 1,900,
- Шаблон:Флагификация – 1 ,300,
- Шаблон:Флагификация – 1,000,
- Шаблон:Флагификация –0,920,
- Шаблон:Флагификация – 0,830,
- Шаблон:Флагификация – 0,770,
- Шаблон:Флагификация – 0,740
- Шаблон:Флагификация – 0,580,
- Шаблон:Флагификация – 0,530,
- Шаблон:Флагификация – 0,390.
- Шаблон:Флагификация - 0,308.
На остальные страны приходится ещё около 2,5 млн тонн в год производимой меди[28].
Производство меди в России
Запасы и добыча в России: см. Добыча полезных ископаемых в России#Медь.
Производство рафинированной меди в России в 2018—2022 годах составляло 0,99—1,04 млн. тонн в год году. В России по состоянию на 2020 год свыше 95% производимой рафинированной меди приходилось на три компании[35]:
| Компания | тыс. тонн | % |
|---|---|---|
| Уралэлектромедь | 440 | 41 % |
| Норильский никель | 420 | 40 % |
| Русская медная компания | 200 | 19 % |
К указанным производителям меди в России в 2008 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское»[36]. В настоящее время развитие проекта на данном месторождении ведёт компания «Удоканская медь», которая в 2023 году выпустила первый медный концентрат[37]. При выходе на полную мощность ожидается выпуск 360 тыс. тонн меди в год[35], что может сделать "Удоканскую медь" одним из крупнейших производителей меди в России.
Современные способы добычи
Сейчас известно более 200 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская Республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду (расположен в Чили). В зависимости от глубины залегания, руда добывается открытым или закрытым методом[38].
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её растворения в слабом растворе серной кислоты и последующего выделения металлической (черновой) меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C.
С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит раствор серной кислоты с медным купоросом. В ходе электролиза происходит повышение концентрации серной кислоты. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлама, который идёт на переработку с целью извлечения ценных металлов. При получении 1000 тонн электролитической меди можно получить до 3 кг серебра и 200 г золота. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[39].
Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в карьере медного рудника.
Стоимость
В январе 2008 года, впервые за всю историю, на Лондонской бирже металлов цены на медь превысили 8000 долларов за тонну. В начале июля цены возросли до 8940 долларов за тонну, что стало абсолютным рекордом начиная с 1979 года — момента начала ведения торгов на бирже. Цена достигла пика в почти 10,2 тыс. долларов в феврале 2011 года[40].
На 2011 год стоимость меди составляла около 8900 долларов за тонну[41]. Вследствие кризиса мировой экономики цена на большинство видов сырья упала, и стоимость 1 тонны меди на 1 сентября 2016 не превышала 4700 долларов[42].
В мае 2021 года цена меди на Лондонской бирже металлов (LME) взлетела до 10 307 долларов за тонну[43]. Пиковая цена зафиксирована в середине октября 2021 — стоимость контракта на одну тонну меди с поставкой через 3 месяца в моменте превышала 10 тыс. долларов[44].
Биологическая роль

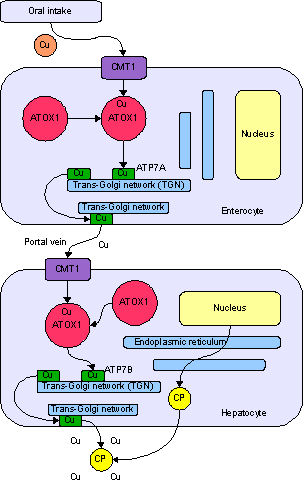
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей[45].
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 1 мг/л (СанПиН 2.1.4.1074-01), однако недостаток меди в питьевой воде также нежелателен. Всемирная организация здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[46].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[46]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[47] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[48]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/H1N1 (т. н. «свиной грипп»)[49].
Органолептические свойства
Излишняя концентрация ионов меди придаёт воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
См. также
Примечания
Литература
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Российский Центр Меди, некоммерческий
- Медь в месторождениях
- copperinfo.org - Некоммерческий ресурс о медиШаблон:Ref-en
Шаблон:Вс Шаблон:Периодическая система элементов Шаблон:Ряд Активности Металлов Шаблон:Металлы и сплавы, используемые для изготовления монет
- ↑ Шаблон:Книга
- ↑ 2,0 2,1 2,2 Шаблон:Публикация
- ↑ Официальные символы Шаблон:Wayback, на сайте Администрации Полевского городского округа
- ↑ Шаблон:Книга
- ↑ Шаблон:Книга
- ↑ 6,0 6,1 Шаблон:Фасмер
- ↑ Шаблон:Книга
- ↑ 8,0 8,1 Ошибка цитирования: Неверный тег
<ref>; для сносокХЭне указан текст - ↑ Шаблон:Из БСЭ
- ↑ Шаблон:Cite web
- ↑ при 20 °С: 394,279 Вт/(м·К), то есть 0,941 кал/(см·сек·°С)
- ↑ 12,0 12,1 Электротехнический справочник. Т. 1. / Составитель И. И. Алиев. — Шаблон:М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- ↑ Шаблон:Книга
- ↑ Шаблон:ХЭ
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья
- ↑ Применение меди Шаблон:Wayback Шаблон:Недоступная ссылка
- ↑ Шаблон:Cite web
- ↑ Шаблон:Книга
- ↑ Шаблон:Книга
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Книга
- ↑ 27,0 27,1 Шаблон:Cite web
- ↑ 28,0 28,1 28,2 Шаблон:Cite web
- ↑ В 2005 г. мировая добыча меди увеличится на 8 % до 15,7 млн т. — Новости металлургии
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ 35,0 35,1 Шаблон:Cite web
- ↑ Металлонвест оплатил лицензию за Удокан
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Добыча меди в России: крупнейшие компании и месторождения Шаблон:Wayback
- ↑ Шаблон:Статья
- ↑ 46,0 46,1 Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web