Карбоновые кислоты
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну (монокарбоновые) или несколько (поликарбоновые) функциональных карбоксильных групп COOH. Кислотные свойства объясняются тем, что данная группа может сравнительно легко отщеплять протоны. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа диссоциации равна 1,75Шаблон:E. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые кислоты.
Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание «овая» и слово «кислота». При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН — пропановая кислота, СН3-С(СН3)2-СООН — 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание «карбоновая» и слово «кислота», не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН — циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН — трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
|---|---|---|---|
| Муравьиная кислота | Метановая кислота | HCOOH | формиаты |
| Уксусная кислота | Этановая кислота | CH3COOH | ацетаты |
| Пропионовая кислота | Пропановая кислота | C2H5COOH | пропионаты |
| Масляная кислота | Бутановая кислота | C3H7COOH | бутираты |
| Валериановая кислота | Пентановая кислота | C4H9COOH | валераты |
| Капроновая кислота | Гексановая кислота | C5H11COOH | капраты |
| Энантовая кислота | Гептановая кислота | C6H13COOH | энантоаты |
| Каприловая кислота | Октановая кислота | C7H15COOH | каприлаты |
| Пеларгоновая кислота | Нонановая кислота | C8H17COOH | пеларогоаты |
| Каприновая кислота | Декановая кислота | C9H19COOH | капринаты |
| Ундециловая кислота | Ундекановая кислота | C10H21COOH | ундеканоаты |
| Лауриновая кислота | Додекановая кислота | C11H23COOH | лаураты |
| - | Тридекановая кислота | C12H25COOH | тридеканоаты |
| Миристиновая кислота | Тетрадекановая кислота | C13H27COOH | миристиаты |
| - | Пентадекановая кислота | C14H29COOH | пентадеканоаты |
| Пальмитиновая кислота | Гексадекановая кислота | C15H31COOH | пальмитаты |
| Маргариновая кислота | Гептадекановая кислота | C16H33COOH | маргараты |
| Стеариновая кислота | Октадекановая кислота | C17H35COOH | стеараты |
| - | Нонадекановая кислота | C18H37COOH | нонадеканоаты |
| Арахиновая кислота | Эйкозановая кислота | C19H39COOH | арахаты |
| - | Генэйкозановая кислота | C20H41COOH | генэйкозаноаты |
| Бегеновая кислота | Докозановая кислота | C21H43COOH | бегенаты |
| - | Трикозановая кислота | C22H45COOH | трикозаноаты |
| Лигноцериновая кислота | Тетракозановая кислота | C23H47COOH | лигноцераты |
| - | Пентакозановая кислота | C24H49COOH | пентакозаноаты |
| Церотиновая кислота | Гексакозановая кислота | C25H51COOH | церотитаты |
| - | Гептакозановая кислота | C26H53COOH | гептакозаноаты |
| Монтановая кислота | Октакозановая кислота | C27H55COOH | монтаноаты |
| - | Нонакозановая кислота | C28H57COOH | нонакозаноаты |
| Мелиссовая кислота | Триаконтановая кислота | C29H59COOH | мелиссаты |
| - | Гентриаконтановая кислота | C30H61COOH | гентриаконтаноаты |
| Лацериновая кислота | Дотриаконтановая кислота | C31H63COOH | дотриаконтаноаты |
| Псилластеариновая кислота | Тритриаконтановая кислота | C32H65COOH | псилластеарилаты |
| Геддовая кислота | Тетратриаконтановая кислота | C33H67COOH | - |
| Церопластовая кислота | Пентатриаконтановая кислота | C34H69COOH | - |
| Гексатриаконтиловая кислота | Гексатриаконтановая кислота | C35H71COOH | - |
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
|---|---|---|---|
| Акриловая кислота | Пропеновая кислота | C2H3COOH | Акрилаты |
| Изокротоновая (квартениловая) кислота | цис-2-бутеновая кислота | C3H5COOH | - |
| Кротоновая кислота | транс-2-бутеновая кислота | C3H5COOH | - |
| Винилуксусная (алиловая) кислота | 3-бутеновая кислота | C3H5COOH | - |
| Аллилуксусная кислота | 4-пентеновая кислота | C4H7COOH | - |
| Изогидросорбовая | транс-2-гексеновая кислота | C5H9COOH | - |
| β-пропенилпропионовая кислота | 4-гексеновая кислота | C5H9COOH | - |
| Капролеиновая кислота | 9-деценовая кислота | C10H19COOH | - |
| Лауролеиновая кислота | цис-9-додеценовая кислота | C11H21COOH | - |
| Миристолеиновая кислота | цис-9-тетрадеценовая кислота | C13H25COOH | - |
| Пальмитолеиновая кислота | цис-9-гексадеценовая кислота | C15H29COOH | - |
| Сапиеновая кислота | цис-6-гексадеценовая кислота | C15H29COOH | - |
| Вацценовая кислота | транс-11-октадеценовая кислота | C17H33COOH | - |
| Петроселиновая кислота | цис-6-октадеценовая кислота | C17H33COOH | - |
| Петроселандовая кислота | транс-6-октадеценовая кислота | C17H33COOH | - |
| Олеиновая кислота | цис-9-октадеценовая кислота | C17H33COOH | Олеаты |
| Элаидиновая кислота | транс-9-октадеценовая кислота | C17H33COOH | - |
| цис-Вакценовая кислота | цис-11-октадеценовая кислота | C17H33COOH | - |
| транс-Вакценовая кислота | транс-11-октадеценовая кислота | C17H33COOH | - |
| Гадолеиновая кислота | цис-9-эйкозеновая кислота | C19H37COOH | - |
| Гондоиновая кислота | цис-11-эйкозеновая кислота | C19H37COOH | - |
| Паулиновая кислота | цис-13-эйкозеновая кислота | C19H37COOH | - |
| Брассидиновая кислота | транс-13-докозеновая кислота | C21H41COOH | - |
| Эруковая кислота | цис-13-докозеновая кислота | C21H41COOH | - |
| Цетолеиновая кислота | цис-11-докозеновая кислота | C21H41COOH | - |
| Нервоновая (селахолевая) кислота | цис-15-тетракозеновая кислота | C23H45COOH | - |
| Ксименовая кислота | 17-гексакозеновая | C25H49COOH | - |
| Люмекеиновая кислота | 21-триаконтеновая | C29H57COOH | - |
| Сорбиновая кислота | транс, транс-2,4-гексадиеновая кислота | C5H7COOH | - |
| Туатаровая кислота | транс, цис-4,6-октадиеновая кислота | C7H11COOH | - |
| Стиллингиновая кислота | цис, цис-2,4-декадиеновая кислота | C9H15COOH | - |
| Линолевая кислота | цис, цис-9,12-октадекадиеновая кислота | C17H31COOH | |
| Руменовая (бовиновая) кислота | цис, транс-9,11-октадекадиеновая кислота | C17H31COOH | |
| Линэлаидиновая кислота | транс, транс-9,12-октадекадиеновая кислота | C17H31COOH | |
| Хирагоновая кислота | цис, цис, цис-6,10,14-гексадекатриеновая кислота | C15H25COOH | |
| Гранатовая кислота | цис, транс, цис-9,11,13-октадекатриеновая кислота | C17H29COOH | - |
| α-Линоленовая кислота | цис, цис, цис-9,12,15-октадекатриеновая | C17H29COOH | - |
| Линоленэлаидиновая кислота | транс, транс, транс-9,12,15-октадекатриеновая | C17H29COOH | - |
| γ-Линоленовая кислота (гамаленовая) кислота | цис, цис, цис-6,9,12-октадекатриеновая кислота | C17H29COOH | - |
| Пуниковая кислота | цис, транс, цис-6,9,12-октадекатриеновая кислота | C17H29COOH | - |
| α-Элеостеариновая кислота | цис, транс, транс-9,12,15-октадекатриеновая | C17H29COOH | - |
| β-Элеостеариновая кислота | транс, транс, транс-9,12,15-октадекатриеновая | C17H29COOH | - |
| Пиноленовая кислота | цис, цис, цис-5,9,12-октадекатриеновая кислота | C17H29COOH | - |
| α-Календовая кислота | транс, транс, цис-8,10,12-октадекатриеновая кислота | C17H29COOH | - |
| Каталповая кислота | транс, транс, цис-9,11,13-октадекатриеновая кислота | C17H29COOH | - |
| Элеостеариновая кислота | цис, транс, транс-9,11,13-октадекатриеновая кислота | C17H29COOH | - |
| Мидовая кислота | цис, цис, цис-5,8,11-эйкозатриеновая кислота | C19H33COOH | - |
| Дигомо-γ-линоленовая кислота | цис, цис, цис-8,11,14-эйкозатриеновая кислота | C19H33COOH | - |
| Стеаридоновая кислота | цис, цис, цис, цис-6,9,12,15-октадекатетраеновая кислота | C17H27COOH | - |
| Арахидоновая кислота | цис, цис, цис, цис-6,9,12,15-эйкозатетраеновая кислота | C19H31COOH | - |
| α-Паринаровая кислота | цис, транс, транс, цис-9,11,13,15-октадекатетраеновая кислота | C17H27COOH | - |
| Адреновая кислота | цис, цис, цис, цис-7,10,13,16-докозатетраеновая кислота | C21H35COOH | - |
| Тимнодоновая кислота | цис, цис, цис, цис, цис-5,8,11,14,17-эйкозапентаеновая кислота | C19H29COOH | - |
| Клупанодоновая кислота | цис, цис, цис, цис, цис-7,10,13,16,19-докозапентаеновая кислота | C21H33COOH | - |
| Цирвоновая кислота | цис, цис, цис, цис, цис, цис-4,7,10,13,16,19-докозагексаеновая кислота | C21H31COOH | - |
| Низиновая кислота | цис, цис, цис, цис, цис, цис-6,9,12,15,18,21-тетракозагексаеновая кислота | C23H35COOH | - |
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
|---|---|---|---|
| Щавелевая кислота | Этандиовая кислота | HOOCCOOH | оксалаты |
| Малоновая кислота | Пропандиовая кислота | HOOCCH2COOH | малонаты |
| Янтарная кислота | Бутандиовая кислота | HOOC(СH2)2COOH | сукцинаты |
| Глутаровая кислота | Пентандиовая кислота | HOOC(СH2)3COOH | глутараты |
| Адипиновая кислота | Гександиовая кислота | HOOC(СH2)4COOH | адипинаты |
| Пимелиновая кислота | Гептандиовая кислота | HOOC(СH2)5COOH | пимелинаты |
| Пробковая кислота | Октандиовая кислота | HOOC(СH2)6COOH | субераты |
| Азелаиновая кислота | Нонандиовая кислота | HOOC(СH2)7COOH | азелаинаты |
| Себациновая кислота | Декандиовая кислота | HOOC(СH2)8COOH | себацинаты |
| - | Ундекандиовая кислота | HOOC(СH2)9COOH | |
| - | Додекандиовая кислота | HOOC(СH2)10COOH | |
| Брассиловая кислота | Тридекандиовая кислота | HOOC(СH2)11COOH | |
| - | Тетрадекандиовая кислота | HOOC(СH2)12COOH | |
| - | Пентадекандиовая кислота | HOOC(СH2)13COOH | |
| Тапсиевая кислота | Гексадекандиовая кислота | HOOC(СH2)14COOH | |
| - | Гептадекандиовая кислота | HOOC(СH2)15COOH | |
| - | Октадекандиовая кислота | HOOC(СH2)16COOH | |
| - | Нонадекандиовая кислота | HOOC(СH2)17COOH | |
| - | Эйкозандиовая кислота | HOOC(СH2)18COOH | |
| Японовая кислота | Генэйкозандиовая кислота | HOOC(СH2)19COOH |
Классификация
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
- ароматические (бензойная кислота);
- алифатические (в том числе предельные (капроновая кислота) и непредельные (акриловая кислота));
- алициклические (хинная кислота);
- гетероциклические (никотиновая кислота).
По числу карбоксильных групп кислоты могут быть:
- одноосновными (уксусная кислота);
- двухосновными (щавелевая кислота);
- многоосновными (лимонная кислота).
При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
История открытия
Уксусная кислота знакома людям с древности. Получение при сухой перегонке (нагревании без доступа воздуха) древесины описано в сочинениях Иоанна Глаубера и Роберта Бойля. Однако природа этого вещества не была известна до XIX века. Алхимики считали, что при брожении вина винный спирт превращается в уксус, принимая на себя частицы соли — винного камня (гидротартрат калия). Ещё в XVIII веке брожение объясняли соединением кислых и горючих начал вина. Лишь в 1814 году Якоб Берцелиус определил состав уксусной кислоты, а в 1845 году немецкий химик Адольф Вильгельм Герман Кольбе осуществил её полный синтез из угля[1].
Муравьиную кислоту впервые получил в 1670 году английский естествоиспытатель Джон Рэй, нагревая муравьёв в перегонной колбе[1].
Нахождение в природе
Разнообразные карбоновые кислоты очень широко распространены в природе.
Одноосновные предельные карбоновые кислоты
- Муравьиная кислота содержится в выделениях муравьёв, крапиве, пчелином яде, сосновой хвое.
- Уксусная кислота — продукт уксуснокислого брожения.
- Масляная кислота образуется при прогоркании сливочного масла.
- Валериановая кислота есть в валериановом корне.
- Капроновая, каприловая и каприновая кислоты получили своё название из-за того что содержатся в козьем молоке (Шаблон:Lang-la — коза).
- Энантовая кислота получила название от растения омежника (Шаблон:Lang-la) из семейства зонтичных.
- Пеларгоновая кислота содержится в летучем масле пеларгонии розовой и других растений семейства гераниевых.
- Лауриновая кислота (также лавровая) имеется в больших количествах в лавровом масле.
- Миристиновая кислота преобладает в масле растений семейства мускатниковых, например в ароматных семенах мускатного дерева — мускатном орехе.
- Пальмитиновую кислоту легче всего выделить из пальмового масла, выжимаемого из ядер кокосового ореха (копры).
- Στέαρ по-гречески означает жир, сало — отсюда название стеариновой кислоты. Вместе с пальмитиновой она относится к наиболее важным жирным кислотам и составляет главную часть большинства растительных и животных жиров. Из смеси этих кислот (стеарина) раньше изготовляли свечи.
- Арахиновая кислота встречается в масле земляного ореха — арахиса.
- Бегеновая кислота содержится в бегеновом масле, которое выжимают из крупных, как орех, семян распространённого в Индонезии растения моринги масличной.
- Практически чистую лигноцериновую кислоту (Шаблон:Lang-la — дерево, древесина и cera — воск) извлекают из смолы бука. Раньше эту кислоту называли также карнаубовой, потому что её довольно много в карнаубском воске, которым покрыты листья бразильской восковой пальмы.
- Кислоты с более длинными молекулами встречаются в основном уже в восках, например церотиновая, монтановая (в горном воске (монтан-воске), от Шаблон:Lang-la — гористые места, горные области), мелиссиновая (в пчелином воске, μέλισσα по-гречески — пчела), лацериновая.
- Разветвлённая фтионовая кислота (3,13,19-триметилтрикозановая) (от Шаблон:Lang-grc — чахотка, туберкулёз) содержится, как и туберкулостеариновая (левовращающий изомер 10-метилоктадекановой, или 10-метилстеариновой), в оболочке туберкулёзной палочки[1][2].
Двухосновные предельные кислоты
- Щавелевая кислота содержится в щавеле, а также в ревене. Эта простейшая двухосновная кислота — продукт распада некоторых аминокислот, например глицина. При нарушении обмена веществ (например, при недостатке витамина B6) в организме человека выделяется её малорастворимая кальциевая соль.
- Янтарная кислота была синтезирована ещё алхимиком Агриколой при прокаливании янтаря[1].
- Малоновая кислота получила своё название от Шаблон:Lang-la — яблоко.
- Фумаровая кислота (от Шаблон:Lang-la — дым) была обнаружена в растении дымянка лекарственная (Fumaria officinalis), которое в античные времена сжигали, чтобы дымом отогнать злых духов.
- Глутаровая кислота (получена из глутаминовой кислоты) получила название от Шаблон:Lang-la — клей, поскольку была найдена в клейковине пшеницы.
- Брассиловая кислота (НООС-(СН2)11-СООН) найдена в масле растений семейства капустных (Brassicaceae), также крестоцветных (Crucíferae)[3].
- Тапсиевая кислота (НООС-(СН2)14-СООН) — от растения тапсия с греческого островка Тапсос, которое употреблялось в древности как лекарственное.
- Японовая кислота (НООС-(СН2)19-СООН) — выделена из высушенного сока некоторых акаций и пальм, растущих в Юго-Восточной Азии[2].
Непредельные карбоновые кислоты
Простейшая из них, акриловая имеет острый запах (на латыни acris — острый, едкий), получается при дегидратации глицерина (при пригорании жиров). Название кротоновой кислоты происходит от растения кротон слабительный (Croton tiglium), из масла которого она была выделена. Ангеликовая кислота была выделена из ангеликового масла полученного из корня растения дягиль лекарственный (Angelica archаngelica или Archаngelica officinalis) — дягеля, он же дудник. А тиглиновая — из того же масла Croton tiglium, что и кротоновая кислота, только названа по второй части этого ботанического термина. Сорбиновая кислота была получена из ягод рябины (на латыни — Sorbus). Эруковая кислота была выделена из масла растения рукола (Eruca) — того же семейства Brassicaceae, что и капуста, а также из рапсового масла. При длительном нагревании с сернистой кислотой эруковая кислота изомеризуется в брассидиновую.
Самая распространённая из высокомолекулярных непредельных кислот — олеиновая. Изомерна ей элаидиновая кислота. Наибольшей биологической активностью обладают кислоты с несколькими двойными связями: линолевая с двумя, линоленовая с тремя и арахидоновая с четырьмя. Полиненасыщенные кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей. Названия этих кислот произошли от греч. elaion и лат. oleum — масло, а название арахидоновой (как и арахиновой) происходит от арахиса. Ненасыщенная рицинолевая кислота выделена из касторового масла, которое содержится в семенах клещевины (Ricinus communis). Другая непредельная трёхосновная аконитовая кислота выделена из ядовитых растений Aconitum семейства лютиковых, а название непредельной двухосновной итаконовой кислоты было получено просто перестановкой букв в названии аконитовой кислоты.
Таририновая кислота с ацетиленовой связью была выделена из горького экстракта коры американского тропического дерева вида Tariri antidesma[2].
Гидроксикислоты
Молочная кислота образуется при молочнокислом брожении сахаров (при прокисании молока и брожении вина и пива).
Яблочная, винная, лимонная, хинная — образуются в вакуолях клеток плодов при частичном окислении глюкозы[1].
Получение
Лабораторные методы получения предельных кислот
Окислительные методы
- Окисление спиртов (реактивом Джонса — раствором оксида хрома(VI) в разбавленной серной кислоте и ацетоне или перманганатом калия в кислой или нейтральной среде)[4]:
- Окисление альдегидов (используются те же реагенты, что и в случае спиртов, а также оксид серебра(I)):
- Окислительная деструкция алкенов — окисление алкенов смесью перманганата калия и периодата натрия в водном ацетоне в нейтральной среде (реакция идёт в две стадии — на первой перманганат окисляет алкен до диола, на второй периодат окисляет диол до кислоты, избыток периодата окисляет Mn4+ до Mn7+, так что перманганата требуется лишь каталитическое количество)[4]:
- Окисление алкилбензолов и других алкиларенов — самый распространённый способ получения ароматических карбоновых кислот. При этом первичные и вторичные алкильные группы окисляются до карбоксильной. В качестве окислителя применяются водный щелочный, нейтральный или солюбилизированный краун-6-эфиром в бензоле (пурпурный бензол) растворы перманганата калия, кислый бихромата натрия или водная азотная кислота[4][5]:
Гидролиз
- Гидролиз тригалогеналканов водным раствором щелочи
- Гидролиз сложных эфиров
- Гидролиз нитрилов и амидов
Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты;
лишь в редких случаях амид устойчив к гидролизу (амид легко гидролизируется в присутствии H2O2 в щелочной среде или нитрит-иона в кислой); удобный лабораторный метод, если нитрил доступен.
Карбоксилирование
- Карбоксилирование металлорганических соединений (в основном реактивов Гриньяра и литийорганических соединений):
- Карбоксилирование илидов фосфора[5]:
- При помощи диизопропиламида лития и других аналогичных амидов можно непосредственно вводить группу -CH2COOH:
Синтез ароматических кислот
Существует несколько специфических методов, применяемых только для синтеза ароматических кислот.
- Реакция Кольбе — Шмитта — карбоксилирование фенолятов металлов (в промышленности эта реакции используется для синтеза салициловой кислоты)[5]:
- Реакция Фриделя-Крафтса с использованием фосгена[5].
- Реакция Фон-Рихтера — ароматическое нитросоединение при реакции с цианидом калия карбоксилируется в орто положении к нитрогруппе:
Другие методы
- Реакция Арндта-Эйстерта — превращение карбоновой кислоты в ближайший гомолог с использованием диазометана:
Используется для получения высших гомологов кислот из низших.
- Серия реакций для превращения в низший гомолог:
В промышленности
- Окисление парафиновых углеводородов воздухом или техническим кислородом при высокой температуре в присутствии катализаторов или без них. Низшие углеводороды (с числом атомов углерода до 8) окисляются главным образом в паровой фазе при повышенном давлении, а высшие (от 16 до 30 атомов карбона для получения кислот от 10 до 20 атомов карбона) — преимущественно в жидкой фазе. Окисление проводят при температуре около 500 °C и атмосферном давлении или при 400 °C под давлением 10-20 МПа (130—200 атмосфер). Катализаторами служат металлы, их оксиды и соли. При получении высших жирных кислот в присутствии катализаторов температуру снижают до 130—150 °C. При окислении углеводородов обычно образуется смесь кислот с различным количеством углеродных атомов.
- Оксосинтез:
а. получают альдегиды и окисляют до соответствующих кислот.
б. получают спирты, а затем сплавляют их при 250—350 °C с щелочью[5]:
в. взаимодействие олефинов с оксидом углерода (II) и водяным паром в присутствии тетракарбонила никеля или фосфорной кислоты при температуре 300—400 °C и давлении 200—500 атмосфер получают смесь кислот нормального и изостроения, например:
Получение непредельных кислот
- 1.Введение карбоксильной группы в олефин:
- 2. Исходят из предельной кислоты и переводят её в ненасыщенную:
Физические свойства

Низшие кислоты с числом атомов углерода до 3 — легкоподвижные бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом. Кислоты с большим количеством атомов углерода — твёрдые вещества, нерастворимые в воде. Плотность муравьиной и уксусной кислот больше единицы, остальных — меньше. Температура кипения возрастает по мере увеличения молекулярной массы, при одном и том же числе углеродных атомов кислоты нормального строения кипят при более высокой температуре, чем кислоты изостроения[6].
У кислот нормального строения есть закономерность: температура плавления кислот с чётным числом атомных углеродов выше, чем температура плавления соседних с нечётным числом. Это объясняется расположением метильной и карбоксильной групп — в кислотах чётного ряда они по разные стороны от оси молекулы, а нечётного — по одну. Благодаря более симметричному строению молекулы кислоты с чётным числом атомов углерода сильнее взаимодействуют между собой в кристаллической решётке и её труднее разрушить при нагревании[6].
Карбоновые кислоты кипят при значительно более высоких температурах, чем спирты. Их молекулы ассоциированы намного сильнее вследствие того что связи в них в большей степени поляризованы по типу . Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом состоянии карбоновые кислоты существуют в основном в виде циклических димеров[2][5], а в жидком происходит и линейная ассоциация[7]. Даже в парах они димеризированы[6]. Две водородные связи довольно прочны, энергия димеризации для муравьиной кислоты составляет 14 ккал/моль[4].
Строение
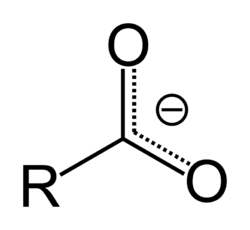
Карбоксильная группа планарна, длина связи C=O в различных кислотах составляет 0,118-0,126 нм, связи C-O — 0,121-0,137 нм — наблюдается выравнивание длин связей углерод-кислород при диссоциации[8]. Карбон карбоксильной группы находится в состоянии sp2-гибридизации, угол O-C-O в различных кислотах составляет 118—122,5°. Дипольный момент карбоксильной группы составляет Шаблон:Nobr. При диссоциации образуется стабилизированный сопряжением анион. В нём обе связи C-O равноценны и составляют 0,127-0,129 нм[8].
Длина водородной связи в димере 0,26 нм[5].
Сила
Карбоновые кислоты являются слабыми кислотами, pKa большинства алифатических кислот составляет 4,8. Электроноакцепторные заместители и кратные связи усиливают кислотные свойства, электронодонорные, наоборот, ослабляют (хотя и в значительно меньшей степени)[5]. Влияние заместителя быстро падает при отдалении от карбоксильной группы[4].
Степень диссоциации карбоновых кислот существенно зависит от природы растворителя. В апротонных растворителях карбоновые кислоты практически недиссоциированы. В протонных растворителях наибольшая диссоциация наблюдается в воде[8]. Шаблон:Начало скрытого блока
| Название | pKa | Название | pKa |
|---|---|---|---|
| СF3COOH | 0,23 | СCl3COOH | 0,64 |
| CHCl2COOH | 1,26 | CH2NO2COOH | 1,48 |
| CF3SO2CH2COOH | 1,88 | CH3SO2CH2COOH | 2,36 |
| NCCH2COOH | 2,47 | CH2FCOOH | 2,59 |
| CH2ClCOOH | 2,86 | CH2BrCOOH | 2,90 |
| CH2ICOOH | 3,18 | CH2OHCOOH | 3,83 |
| C6H5CH2CH2COOH | 4,66 | CH3С≡С-СOOH | 1,84 |
| CH≡C-COOH | 2,62 | CH2CHCOOH | 4,65 |
| транс-CH3CH=CH-COOH | 4,68 | транс-C6H5CH=CH-COOH | 4,44 |
| о-CH3OC6H4COOH | 4,08 | м-CH3OC6H4COOH | 4,10 |
| п-CH3OC6H4COOH | 4,50 | (CH3)3C6H4COOH | 4,20 |
| п-(CH3)3C6H4COOH | 4,38 | п-FC6H4COOH | 4,15 |
| п-ClC6H4COOH | 4,00 | HCOOH | 3,75 |
| CH3COOH | 4,74 | CH3CH2COOH | 4,87 |
| CH3CH2CH2COOH | 4,81 | CH3CH(CH3)COOH | 4,84 |
| (CH3)3CCOOH | 5,03 | C6H5COOH | 4,2 |
| о-CH3C6H4COOH | 3,91 | м-CH3C6H4COOH | 4,25 |
| п-CH3C6H4COOH | 4,37 | о-O2NC6H4COOH | 2,17 |
| м-O2NC6H4COOH | 3,46 | п-O2NC6H4COOH | 3,43 |
| C6F5COOH | 1,75 | 2,4,6-(O2N)3C6H2COOH | 0,65 |
Карбоновые кислотные остатки
| Кислотный остаток | Название | ||
|---|---|---|---|
| ацилгруппа | название | ацилатгруппа | |
| Н-CO¯ | Формил | H-COO¯ | Формиат |
| CH3-CO¯ | Ацетил | CH3-COO¯ | Ацетат |
| СН3СН2-СО¯ | Пропионил | СН3СН2-СОO¯ | Пропионат |
| СН3СН2CH2-СО¯ | Бутирил | СН3СН2CH2-СОO¯ | Бутират |
| С3Н7-СО¯ | Изобутирил | С3Н7-СОO¯ | Изобутират |
| СН3(СН2)3-СО¯ | Валериил | СН3(СН2)3-СОO¯ | Валерат |
| С6H5-СО¯ | Бензоил | С6H5-СОO¯ | Бензоат |
Характерные химические реакции и получение важных производных

Кислотные свойства
Карбоновые кислоты проявляют типичные кислотные свойства — при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов, могут вытеснять более слабую кислоту из её соли и сами могут быть вытеснены более сильной кислотой:
Соли карбоновых кислот в воде подвергаются гидролизу и имеют щелочную реакцию.
Восстановление
Карбоновые кислоты восстанавливаются до первичных спиртов с помощью литийалюминийгидрида при кипячении в тетрагидрофуране или дибораном в более мягких условиях, кроме того при этом не восстанавливаются группы NO2, COOR и CN[4]:
Избирательное восстановление до альдегидов достигается обработкой Li в метиламине (образующийся альдегид защищается растворителем в виде азометина)[5]:
Галогенирование
Радикальное галогенирование кислот хлором при облучении УФ-светом при 300—400 °C идёт неселективно и приводит к трудноразделяемой смеси изомеров. Региоселективное α-галогенирование достигается по методу Гелль-Фольгарда-Зелинского — кислоту обрабатывают хлором или бромом в присутствии красного фосфора или соответствующих хлорида или бромида фосфора(III)[4].
Реакции нуклеофильного замещения у ацильного атома углерода
Шаблон:Main Для реакций нуклеофильного замещения у sp2-гибридного ацильного атома углерода реализируется двухстадийный механизм присоединения-отщепления. В первой стадии нуклеофильный агент присоединяется к карбоновой кислоте (или её производному) с образованием заряженного (для анионного нуклеофильного агента) или незаряженного (для нейтрального) тетраэдрического интермедианта. Во второй стадии от этого интермедианта отщепляется в виде аниона или нейтральной молекулы уходящая группа Z и образуется конечный продукт присоединения. Реакция обратима, однако если Z- и Nu- сильно различаются по своей основности и нуклеофильности, она становится необратимой[4].
- Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
Выделение воды идёт за счёт гидроксила карбоксильной группы кислоты и атома водорода гидроксила спирта. В то же время при применении кислоты, меченной 18O по карбонилу наблюдалась потеря активности. Это свидетельствует о том, что в реакции затрагивается и карбонильный атом кислорода[8].
- Реакция с литийорганическими соединениями — важный метод получения кетонов[5]:
- '
- С магнийорганическими соединениями карбоновые кислоты реагируют только в жёстких условиях, образуя, как правило, третичные спирты[5].
- Под действием SOCl2 и PCl5 карбоновые кислоты превращаются в соответствующие хлорангидриды:
- Ангидриды можно получить дегидратацией кислот, однако этот метод применим не ко всем кислотам (так в основном получают лишь ангидриды сильных карбоновых кислот[4]). Их получают в основном реакцией галогенангидридов с солями карбоновых кислот. Таким образом получают и смешанные ангидриды[6]:
Двухосновные янтарная и глутаровая кислоты при нагревании легко превращаются во внутренние ангидриды[7].
Кетены являются внутренними ангидридами кислот. Их получают в основном элиминированием хлорангидридов кислот. Кетен можно получить пиролизом уксусной кислоты и уксусного ангидрида[5][8].
Получение амидов и нитрилов
При нагревании аммонийных солей карбоновых кислот образуются их амиды:
При нагревании амидов с P2O5 отщепляется вода и образуются нитрилы кислот:
Декарбоксилирование
Реакция Бородина-Хунсдиккера — серебряная соль карбоновой кислоты при нагревании с раствором брома в CCl4 превращается в алкилгалогенид[4]:
При окислении-декарбоксилировании тетраацетатом свинца в зависимости от условий образуются алканы, алкены или сложные эфиры уксусной кислоты:
Карбокатион, отщепляя протон превращается в алкен, а захватывая ацет-анион — в эфир[4].
Реакция Кольбе — электрохимическая реакция получения углеводородов из карбоновых кислот[4]:
Реакция Шмидта — при реакции с азотистоводородной кислотой образуются амины (промежуточным продуктом является изоцианат) и выделяется углекислый газ:
При нагревании в присутствии гидроксида бария карбоновые кислоты (а также их кальциевые и бариевые соли) декарбоксилируются с образованием симметрических кетонов. Именно эта реакция долгое время была основным способом получения ацетона[9]:
Примером внутримолекулярной реакции данного типа является получение циклопентанона пиролизом адипиновой кислоты и циклогексанона пиролизом пимелиновой кислоты в присутствии солей бария или кальция (циклизация Ружички)[7].
Простейшие двухосновные кислоты (щавелевая и малоновая) термически неустойчивы и легко декарбоксилируются[7]:
Химические методы анализа карбоновых кислот
Качественный анализ карбоновых кислот
- Определения pH водных или водно-спиртовых растворов, выделение CO2 из растворов NaHCO3.
- Цветная реакция — превращение карбоновых кислот в гидроксамовые и образование окрашенных гидроксаматов Fe.
- Идентификация по температуре плавления производных — ряд производных карбоновых кислот имеют чёткую температуру плавления, применяемую для их идентификации.
- Муравьиная кислота — простейшая карбоновая кислота, при этом она содержит и альдегидную группу, поэтому подобно альдегидам осаждает серебро из аммиачных растворов нитрата серебра.
Количественный анализ карбоновых кислот
- Водное и неводное титрование.
- Определение активного водорода по методу Чугаева — Церевитинова.
- Превращение в гидроксамовые кислоты и их колориметрический анализ.
- Эстерификация метанолом и количества выделившийся воды реактивом Фишера.
- Декарбоксилирование и определение выделившегося углекислого газа.
- Газо-жидкостная и тонкослойная хроматографии[5].
Спектральные методы анализа карбоновых кислот
ИК-спектроскопические методы анализа карбоновых кислот
В ИК-спектрах карбоновых кислот проявляются две характеристические полосы поглощения относящиеся к валентным колебаниям гидроксильной группы — 3550−3500 см−1 для свободной и 3330−2500 см−1 для связанной водородной связью и карбоксильной — 1725−1700 см−1 для алифатических кислот, 1715−1690 см−1 для α,β-непредельных, 1700−1680 см−1 для ароматических и 1680−1650 см−1 для связанных внутримолекулярной водородной связью. Карбоксилат-анион имеет две полосы поглощения — 1610−1550 см−1 и 1420−1335 см−1[5][8].
Масс-спектрометрические методы анализа карбоновых кислот
В масс-спектрах карбоновых кислот наиболее интенсивны пики ацил-катионов, образующихся при разрыве ацильной связи. Имеют место также потеря алкильного радикала с образованием иона CO2H+ с m/z=45, α- и β-расщепление и перегруппировки, для содержащих атом H в γ-положении характерна перегруппировка Мак-Лафферти. Для карбоновых кислот нормального строения характерно наличие пика иона с m/z=60, соответствующего уксусной кислоте[8][10].
УФ-спектроскопические методы анализа карбоновых кислот
В УФ-спектре имеются слабые полосы перехода n→π* при 200—210 нм. Для α,β-непредельных характерен более сильные полосы перехода π→π* при 210—220 нм[5].
ЯМР-спектроскопические методы анализа карбоновых кислот
Спектры ЯМР характеризуются химическим сдвигом протона карбоксильной группы при 10,5-12 м.д.[5].
Применение
Карбоновые кислоты — исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов — сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот — пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей — пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы — компоненты лаков и пластмассы. Амиды кислот — эмульгаторы и флотоагенты.
Муравьиная кислота является сильным восстановителем и обладает сильным бактерицидным эффектом. На этих свойствах основано её применение в медицине (используется муравьиный спирт — 1,25 % спиртовой раствор муравьиной кислоты), как консерванта (при силосовании зелёной массы и фруктовых соков) и для дезинфекции. Также применяется для обработки кожи и отделке текстиля и бумаги. Широко используются эфиры муравьиной кислоты — метилформиат, этилформиат и изоамилформиат[11].
Уксусная кислота — в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество. В промышленности — растворитель лаков, коагулянт латекса, ацетилирующий агент[12].
Масляная кислота — для получения ароматизирующих добавок (эфиры метилбутират и изоамилбутират — ароматизаторы в промышленности), пластификаторов и флотореагентов, как экстрагент щелочно-земельных металлов.[13]
Щавелевая кислота — в металлургической промышленности (удаление окалины), в качестве протравы при крашении, для отбелки соломы, при приготовлении чернил, как реагент в аналитической органической химии[14].
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH — в качестве поверхностно-активных веществ (натриевая соль), смазочных материалов в металлообработке, как компонент и эмульгатор кремов и мазей. Эфиры — антиоксиданты, стабилизаторы пищевых продуктов, компоненты клеящих паст и для обработки текстиля и кожи[15].
Олеиновая кислота C17H33COOH — флотореагент при обогащении руд цветных металлов.
См. также
Литература
- Общая органическая химия т. 4 под ред. Д. Бартона и Д. Оллиса. М.: Химия. 1983
- Сайкс П. Механизмы реакций в органической химии. М.: Химия. 1991
- Дж. Роберт, М.Касерио «Основы органической химии» т. 1 Издание 2-е, дополненное. 1978
- Шаблон:ВТ-ЭСБЕ
Примечания
Шаблон:Внешние ссылки Шаблон:Органические вещества
- ↑ 1,0 1,1 1,2 1,3 1,4 Шаблон:Книга
- ↑ 2,0 2,1 2,2 2,3 Шаблон:Cite web
- ↑ Шаблон:ВТ-ЭСБЕ
- ↑ 4,00 4,01 4,02 4,03 4,04 4,05 4,06 4,07 4,08 4,09 4,10 4,11 Шаблон:Книга
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 5,11 5,12 5,13 5,14 5,15 5,16 Шаблон:Статья
- ↑ 6,0 6,1 6,2 6,3 Шаблон:Книга
- ↑ 7,0 7,1 7,2 7,3 Шаблон:Книга
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 8,6 Шаблон:Книга
- ↑ Шаблон:Книга
- ↑ Шаблон:Cite web
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья
- ↑ Шаблон:Статья



